Um estudo publicado pela revista Science revela a forma de actuação das sulfamidas (também conhecidas como sulfonamidas) como antibióticos. O estudo revela a forma como estes medicamentos actuam sobre as bactérias. O estudo também apresenta propostas para o desenvolvimento de novos medicamentos, capazes de ultrapassar as resistências que as bactérias desenvolvem às sulfamida.
As sulfamidas foram o primeiro grupo de antibióticos produzido em série, na década de 1930. Actuam sobre as bactérias atacando a enzima dihidropteroato sintase, que como o nome indica catalisa a (facilita a reacção de) formação de dihidropteroato, precursor de folato. O folato é um precursor de componentes do DNA e das proteínas, e é necessário para a reprodução das bactérias (patogénicas ou não). As sulfamidas actuam “imitando” uma das moléculas que participa na reacção catalisada pela DHPS. A figura em baixo representa a enzima DHPS e (a verde) as moléculas que participam na reacção catalizada pela enzima, p-ABA e pterina (Crédito: Swarbrick/ Simpson/Scammells/ Monash University).
Os mamíferos, entre eles os humanos, não conseguem produzir folato. As nossas necessidades de folato são satisfeitas pela dieta e pela flora intestinal (bactérias e outros microrganismos que vivem no nosso intestino). Por isso não somos afectados pelas sulfaminas. Mas sem capacidade de produzir DNA e proteínas, as bactérias sobre o “efeito” das sulfamidas não se conseguem reproduzir e acabam por desaparecer. Infelizmente as bactérias ganham resistência à actuação das sulfamidas com alguma facilidade. A resistência das bactérias é provocada por mutações na enzima DHPS que “dificultam” a ligação das sulfamidas.
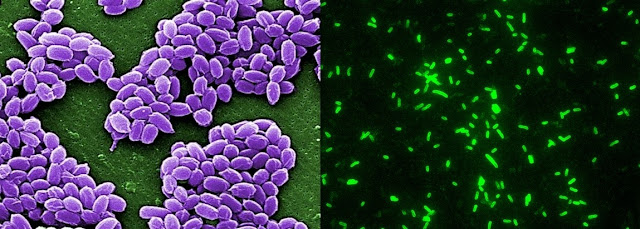
Os autores do estudo publicado pela Science estudaram a fundo a DHPS de duas bactérias a Bacillus anthracis (bactéria gram-positiva que causa o antraz) e a Yersinia pestis (bactéria gram-negativa que causa a peste). A análise da enzima foi feita recorrendo à técnica de cristalografia de raio X. Esta técnica permite determinar a estrutura (forma e organização) de biomoléculas como as enzimas. Na figura em baixo é possível ver duas fotografias de culturas de bactérias de Bacillus anthracis (à esquerda) e Yersinia pestis (à direita) [Crédito: CDC/Laura Rose/Janice Haney Carr (esqueda) e CDC/ Larry Stauffer/Oregon State Public Health Laboratory (direita)]
O estudo permitiu explicar o mecanismo de acção da enzima, a actuação das sulfamidas como inibidoras da actuação da enzima e as mutações que tornam a enzima insensível à acção das sulfamidas. A DHPS é uma enzima que catalisa a reacção entre duas moléculas, o ácido para-aminobenzoico (p-ABA) e o dihidropteridina-hidroximetil-pirofosfato (DHPP). A figura em baixo representa os substractos e os produtos da reacção catalisada pela enzima DHPS ((Crédito: Swarbrick/ Simpson/Scammells/ Monash University).
O DHPP liga-se primeiro a uma “bolsa” fixa da enzima e o p-ABA liga-se a uma bolsa que se mantem apenas temporariamente. Os autores do artigo conseguiram ainda comprovar que o mecanismo que permite a formação do dihidropteroato, o produto da reacção catalisada pela DHPS é um mecanismo de substituição nucleótida do tipo SN1.
A bolsa onde se liga o p-ABA é formada a partir de dois loops da enzima. É a esta bolsa que se ligam as sulfamidas, que actuam como inibidores, bloqueando a actuação da enzima. A figura seguinte mostra as representações das moléculas de p-ABA e da sulfamida, que apresentam uma representação a 2D semelhante (Crédito: Swarbrick/ Simpson/Scammells/ Monash University).
Os autores do estudo determinaram que a enzima DHPS de estirpes de bactérias resistentes à acção das sulfamidas tem mutações nos locais em volta da ligação da p-ABA, onde o antibiótico também se liga. Estas mutações dificultam (ou até impedem) a ligação do antibiótico mas quase não alteram a ligação do p-ABA.
No entanto, na DHPS, a zona dos loops que formam a bolsa de ligação do p-ABA está conservada, ou seja, não são conhecidas enzimas como mutações nessa zona. Muito provavelmente isto acontece porque qualquer mutação nos loops inactiva a enzima. Esta informação é muito importante, porque permite a criação de novos antibióticos que actuem sobre a DHPS ligando-se aos loops. Como a zona dos loops é conservada vai ser mais difícil o aparecimento de estirpes de bactérias resistentes a antibióticos que actuem nessa zona.



Como prometido vim ver o tão falado blog e realmente é digno de reconhecimento, está bastante interessante e os titulos são cativantes e apelativos, espero que continue a escrever.
ResponderEliminarBeijinhos
Inês